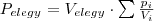Az oldal tölt...
319
319
| Kategória: |
Cikk
- Törvény
- Törvény
|
Évfolyam: |
10. |
| Kulcsszó: |
Gázok egyéb állapotváltozása |
Lektorálás: |
Nem lektorált |
Dalton törvénye
John Dalton(1776-1844) empirikus törvényét 1801-ben állította fel mérései alapján. A törvény feltételezi, hogy a gáz részecskéi nem lépnek reakcióba egymással és a részecskék közötti távolsághoz képest a részecskék mérete elhanyagolható. Nagy nyomású reális gázok esetében a részeszkék közelsége miatt fellépő erők miatt nagy eltérés mutatkozik Dalton törvényéhez képest.
A törvényt az egyetemes gáztörvény (
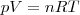
) átrendezett alakja segítségével
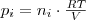
is igazolhatjuk szintén ideális gázok esetére.
Mivel a gázelegy részeiparciális nyomásának összege:
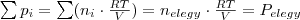
, azaz a gázelegy nyomása. Ezzel az állítást beláttuk.
Ezzel a módszerrel meghatározhatjuk gázok mólarányát a nyomásaik arányának ismeretében.(lásd a korábban levezetett képletek)
A törvény általánosabban is kimondhatjuk ha nem a parciális nyomások, hanem a különböző térfogatú és nyomású ideális gázok
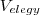
térfogatú edénybe történő elegyítésének esetére ha a hőmérseklet a különböző gázok esetében megegyezik és állandó. Ez lényegében a Boyle-Mariotte-törvény általánosítása is egyben. Azaz:
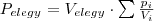
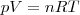 ) átrendezett alakja segítségével
) átrendezett alakja segítségével 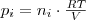 is igazolhatjuk szintén ideális gázok esetére.
is igazolhatjuk szintén ideális gázok esetére. 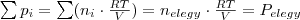 , azaz a gázelegy nyomása. Ezzel az állítást beláttuk.
, azaz a gázelegy nyomása. Ezzel az állítást beláttuk.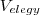 térfogatú edénybe történő elegyítésének esetére ha a hőmérseklet a különböző gázok esetében megegyezik és állandó. Ez lényegében a Boyle-Mariotte-törvény általánosítása is egyben. Azaz:
térfogatú edénybe történő elegyítésének esetére ha a hőmérseklet a különböző gázok esetében megegyezik és állandó. Ez lényegében a Boyle-Mariotte-törvény általánosítása is egyben. Azaz: