Az oldal tölt...
222
222
| Kategória: |
Törvény
|
Évfolyam: |
9. |
| Kulcsszó: |
Kinetikus gázelmélet |
Lektorálás: |
Nem lektorált |
Szerző: |
F2011c.hn |
Gay-Lussac II. törvénye
Az állandó térfogaton (V=állandó) létrejött nyomásváltozás (ΔP) egyenesen arányos a hőmérséklet-változással (
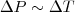
), egyenesen arányos a gáz 0 C-on mért nyomásával (
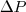
~
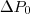
) , továbbá független az anyagi minőségétől. Így a nyomásváltozás:
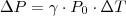
, ahol a hőmérséklet mértékegysége KELVIN! és
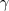
a gáz hőtágulási együtthatója ami
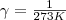
. Tehát ekkor a gáz nyomása:
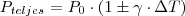
Ideális gáz izochor folyamata esetén:
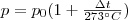
, ahol
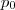
a gáz
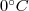
-on mért nyomása.
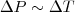 ), egyenesen arányos a gáz 0 C-on mért nyomásával (
), egyenesen arányos a gáz 0 C-on mért nyomásával ( 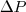 ~
~ 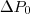 ) , továbbá független az anyagi minőségétől. Így a nyomásváltozás:
) , továbbá független az anyagi minőségétől. Így a nyomásváltozás: 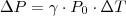 , ahol a hőmérséklet mértékegysége KELVIN! és
, ahol a hőmérséklet mértékegysége KELVIN! és 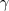 a gáz hőtágulási együtthatója ami
a gáz hőtágulási együtthatója ami 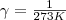 . Tehát ekkor a gáz nyomása:
. Tehát ekkor a gáz nyomása: 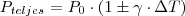
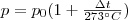 , ahol
, ahol 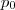 a gáz
a gáz 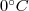 -on mért nyomása.
-on mért nyomása.




